Die weltweit ersten transgenen Ameisen zeigen, wie Kolonien auf einen Alarm reagieren
[ad_1]
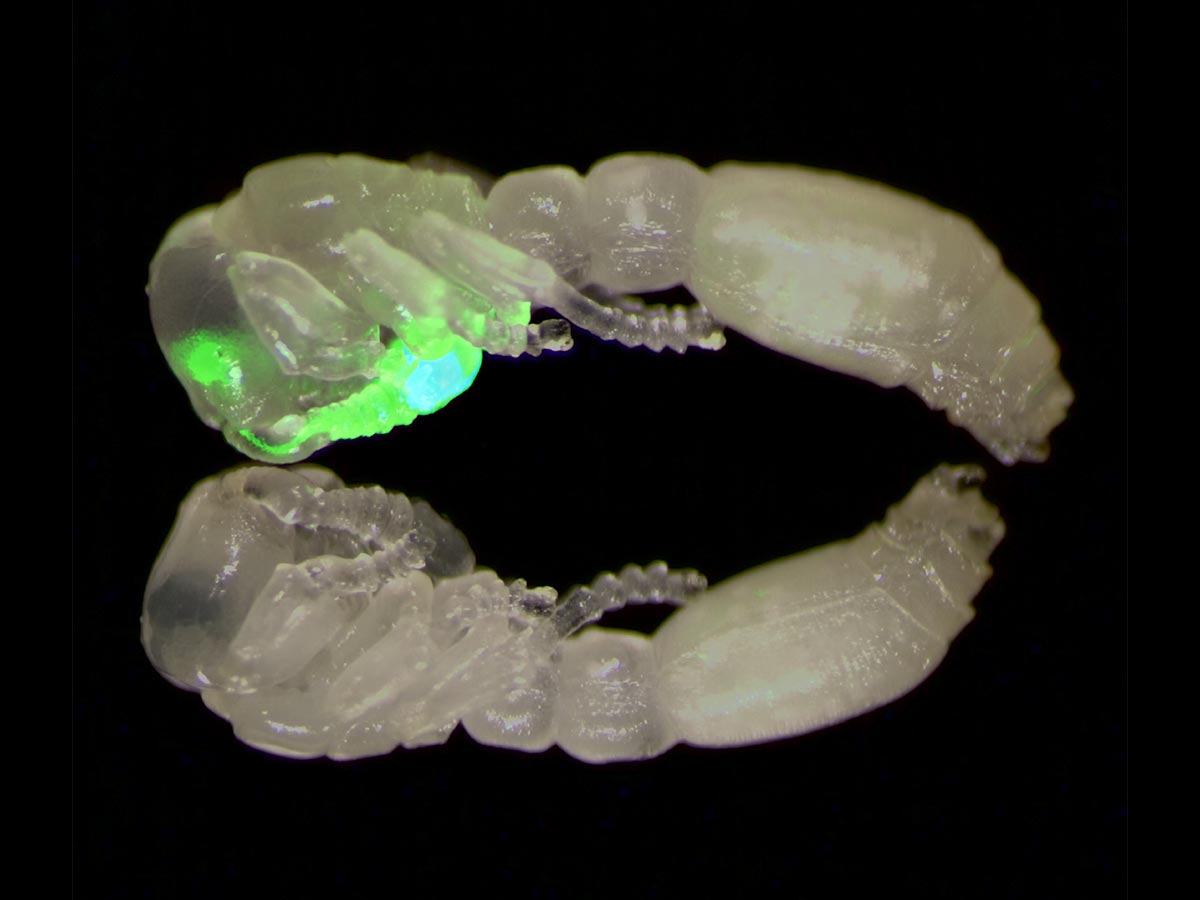
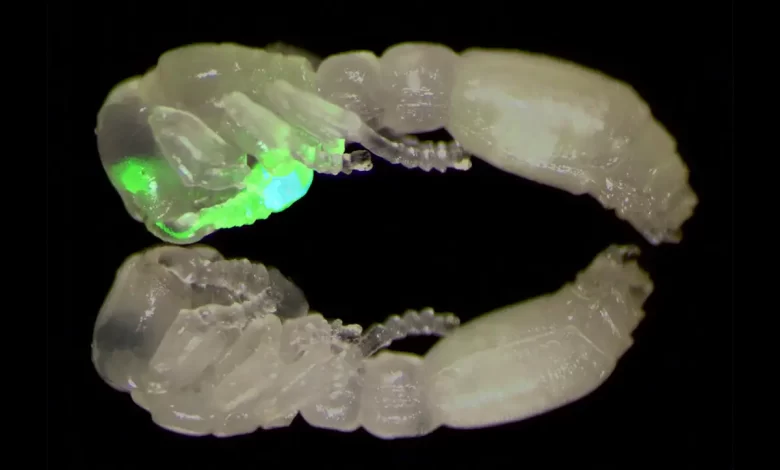
Ein Verbund aus zwei klonalen Räuberameisenpuppen, von denen eine transgen ist und den grün fluoreszierenden Kalziumindikator GCaMP in ihren olfaktorischen sensorischen Neuronen exprimiert, die sich in den Antennen und Antennenlappen des Gehirns befinden. Bildnachweis: Laboratory of Social Evolution and Behavior an der Rockefeller University
Wissenschaftler haben die ersten transgenen Ameisen entwickelt, um Einblicke in das Geruchssystem der Ameisen zu gewinnen. Sie fanden heraus, dass Alarmpheromone nur bestimmte Bereiche im System aktivieren, was das bisherige Verständnis der Geruchsdatenverarbeitung bei Ameisen in Frage stellt. Dieser Durchbruch ermöglicht die weitere Erforschung asozialen Verhaltens.
Ameisen navigieren durch ihre aromareiche Welt mithilfe einer Reihe von Geruchsrezeptoren und chemischen Signalen, die Pheromone genannt werden. Ob sie nun nach Nahrung suchen oder das Nest verteidigen, ob sie sich paaren oder sich um ihre Jungen kümmern: Ameisen senden und empfangen im Laufe ihres Lebens chemische Signale. Wie wichtig dieses System ist, wird dadurch unterstrichen, wie gut das Ameisengehirn für die Verarbeitung der Fülle an Düften ausgestattet ist: Das olfaktorische Verarbeitungszentrum im Gehirn der Ameise hat zehnmal so viele Unterteilungen wie beispielsweise Fruchtfliegen, obwohl ihr Gehirn etwa 10-mal so groß ist die gleiche Größe.
Und doch ist weitgehend unbekannt, wie das Geruchssystem der Ameise Duftdaten kodiert. Um das Rätsel zu lösen, haben Forscher der Rockefeller University die weltweit ersten transgenen Ameisen entwickelt, die mit olfaktorischen sensorischen Neuronen gezüchtet wurden, die als Reaktion auf Geruchsstoffe grün blinken. Ihre Ergebnisse veröffentlichten sie am 14. Juni in der Fachzeitschrift Zelle.
Im Gegensatz zu früheren Erkenntnissen ergab die Studie, dass nur wenige spezifische Bereiche des Geruchssystems als Reaktion auf Alarmpheromone aufleuchteten, d. h. Gefahrensignale, die Panik und Nesträumung auslösen. Die Ergebnisse werfen Fragen darüber auf, wie sensorische Informationen im Ameisengehirn verarbeitet werden – und eröffnen verlockende Möglichkeiten, aufzudecken, was Hunderte anderer Geruchsrezeptoren vorhaben.
„Neurogenetische Werkzeuge haben in den letzten Jahrzehnten das Gebiet der Fruchtfliegen-Neurowissenschaft revolutioniert, während die Neurowissenschaft sozialer Insekten im Wesentlichen steckengeblieben ist“, sagt Daniel Kronauer von Rockefeller, Leiter des Laboratory of Social Evolution and Behavior. „Unsere technischen Durchbrüche ermöglichen es uns nun endlich, diese leistungsstarken Werkzeuge bei Ameisen anzuwenden, um ihr Sozialverhalten zu untersuchen.“
eine Welt voller Gerüche
Im Jahr 1958 berichtete EO Wilson, dass ein Sekret aus der Unterkieferdrüse von Ernteameisen ihre Nestkameraden dazu veranlasste, ihr Tempo zu beschleunigen und Verhaltensweisen zur Kolonieverteidigung anzunehmen. Er nannte diese Reaktion „Alarmverhalten“. Seitdem haben Wissenschaftler dokumentiert, dass das Alarmverhalten und viele andere komplexe soziale Aktivitäten in Ameisenkolonien durch eine Vielzahl von Pheromonen reguliert werden.
Die Geruchsrezeptoren der Ameisen befinden sich auf Neuronen in ihren Antennen, die ihre Eingaben an Gehirnzentren senden, die als Antennenlappen bezeichnet werden. Die Antennenlappen bestehen aus speziellen Strukturen, den sogenannten Glomeruli, die für die Geruchsverarbeitung unerlässlich sind. Einige Ameisen haben mehr als 500 Glomeruli – eine Fülle, die vermutlich mit ihrer erhöhten Fähigkeit zusammenhängt, Pheromone wahrzunehmen und zwischen ihnen zu unterscheiden. Frühere Arbeiten aus Kronauers Labor haben gezeigt, dass Ameisen, deren Geruchsrezeptoren ausgeschaltet wurden, nicht auf Pheromonsignale reagieren können.
In dieser Studie erzeugten die Forscher ihre transgenen Probanden, indem sie die Eier klonaler Räuberameisen – einer Königin ohne Königin – injizierten[{” attribute=””>species composed entirely of blind female workers—with genetic material encoding the synthetic protein GCaMP, which lights up neon green when calcium levels change during cellular activity.
“Our goal was to get GCaMP expressed only in a single cell type—the olfactory sensory neurons,” says lead author Taylor Hart, a researcher in Daniel Kronauer’s lab.
This was important because the antennal lobe is composed of multiple cell types: sensory neurons, projection neurons that carry sensory data to other parts of the brain, and lateral interneurons that link everything together. “Those other cell types can make signal-to-noise ratio poor, because they can be doing other activities, such as computations, processing information, and modulating signals,” Hart says. All of this can obscure what the olfactory neurons are doing.
Finding the panic button
While successfully breeding a small group of ants with GCaMP expression in the olfactory sensory neurons, the team also developed a sophisticated two-photon calcium imaging technique that allowed them to record neural activity throughout the entire antennal lobes of live ants for the first time.
The researchers decided to focus on alarm pheromones, because they are particularly volatile and elicit strong and robust behavioral responses. They found that adult ants that detected the scents immediately scrambled to gather as many eggs in their mandibles as they could and then made a break for it, fleeing into an adjacent section of the test chamber.
Hart and her team then used their new techniques to monitor GCaMP fluorescence levels in the antennal lobes of 22 transgenic ants as they exposed them to a range of odors, including the alarm pheromones (which smell fruity to the human nose). The flashes clustered in six glomeruli in one region, suggesting that area may act as the brain’s panic button.
“We were expecting that a large portion of the antennal lobe would show some kind of response to these alarm pheromones,” Hart says. “Instead, we saw that the responses were extremely localized. Most of the antennal lobe did not respond at all.”
Hart says the findings reveal details about how the ant brain processes sensory input. Researchers have wondered whether the activity is privatized, with each glomerulus responding only to one or a few specific stimuli, or distributed, with unique combinations of glomeruli activated by a stimulus. A brain with more than 500 glomeruli that operated in a distributed way, with hundreds of sensors firing at once, would need extraordinary computational power when it comes to sensory processing, Hart says.
“Most of the odors we tested activated only a small proportion of the total glomeruli,” she says. “It seems that privatization is the way in the ant antennal lobe.”
Tools for the future
Considering that only six glomeruli responded out of 500, Hart wonders, “What do they need all these different glomeruli for? The fruit fly gets by with just 50.”
It will now be easier to find out why ants have a greater need to differentiate odor stimuli than other insects, Kronauer says—and not only because Hart has since bred hundreds of transgenic ants who differ from their wild counterparts only in their ability to signal in fluorescence, providing a robust pool for future research.
“The tools that Taylor developed open up a really big range of questions that were inaccessible to us until now,” he says. These include associating specific glomeruli with the variety of pheromones ants use for things like raiding, recruitment, and distinguishing between nestmates and outsiders. “There are also interesting developmental questions about how the ant olfactory system gets assembled, because it’s so complex. Larvae also have olfactory sensory neurons, so now we can look at their sensory capabilities.”
Reference: “Sparse and stereotyped encoding implicates a core glomerulus for ant alarm behavior” by Taylor Hart, Dominic D. Frank, Lindsey E. Lopes, Leonora Olivos-Cisneros, Kip D. Lacy, Waring Trible, Amelia Ritger, Stephany Valdés-Rodríguez and Daniel J.C. Kronauer, 14 June 2023, Cell.
DOI: 10.1016/j.cell.2023.05.025
[ad_2]
Source link